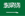1. Dissociation directe et adsorption des molécules d'eau
Sur les sites métalliques insaturés d'oxydes métalliques ou d'oxydes semi-conducteurs (tels que Ti4+, Fe3+), les molécules d'eau s'adsorbent d'abord sous forme moléculaire, suivies d'un clivage de la liaison O-H, résultant en des groupes hydroxyles pontés ou terminaux (M-OH) et des atomes d'hydrogène de surface. La force motrice thermodynamique de ce processus provient de la forte acidité de Lewis des ions métalliques, qui rend les molécules d’eau faciles à dissocier. Les expériences et les calculs DFT indiquent que les surfaces couvertes à faible teneur en oxygène ont tendance à se dissocier et à s'adsorber, tandis que les surfaces couvertes à haute teneur en oxygène ont tendance à adsorber les molécules.
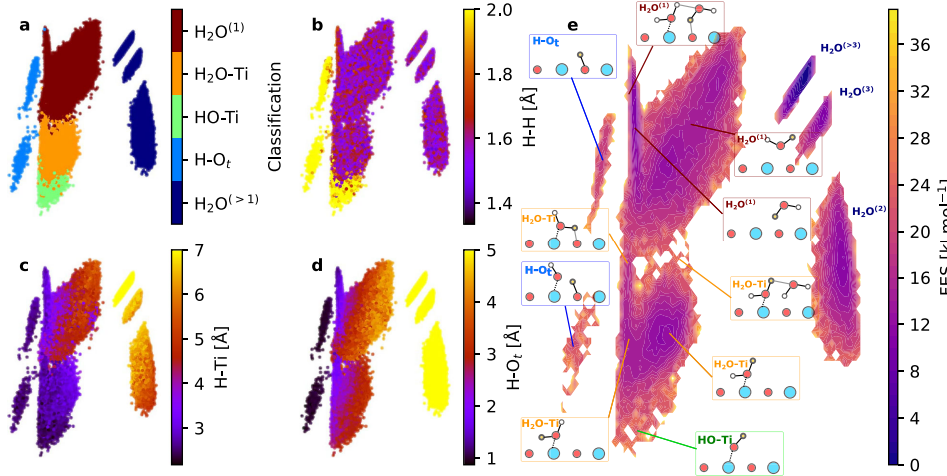
2. Génération d'hydroxyle médiée par la lacune d'oxygène (VO)
Les lacunes en oxygène à la surface fournissent des électrons, ce qui rend les molécules d'eau adsorbées plus sujettes à la dissociation. Une fois que les molécules d'eau sont adsorbées au niveau de la lacune, deux groupes hydroxyle sont générés, dont l'un remplit la lacune et l'autre s'accroche au métal adjacent. Ce mécanisme explique le phénomène d'augmentation significative de la densité d'hydroxyle dans des conditions réductrices ou à haute température, et est étroitement lié aux changements dans le nombre de coordination des ions métalliques.
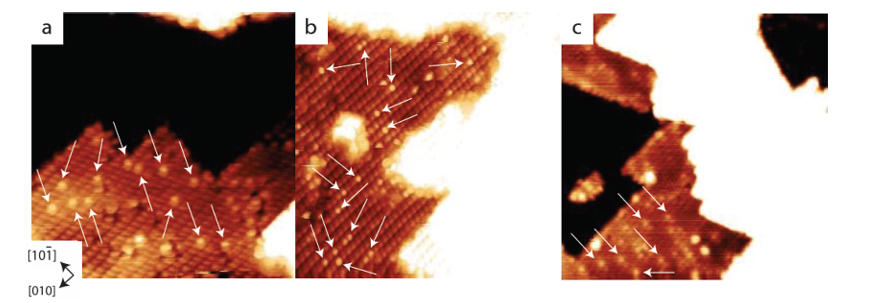
3. Débordement d’hydrogène ou d’atome d’hydrogène
A l'interface métal/oxyde, H2 se dissocie sur le métal pour former H ⁺/H ⁻, qui migre ensuite vers la surface de l'oxyde métallique par débordement d'hydrogène et forme des groupes hydroxyles avec l'oxygène de surface. Ce processus a été directement observé dans les systèmes catalytiques tels que l’oxydation du CO à basse température, et le débordement d’hydrogène a considérablement augmenté le taux de génération de groupes hydroxyles en surface.
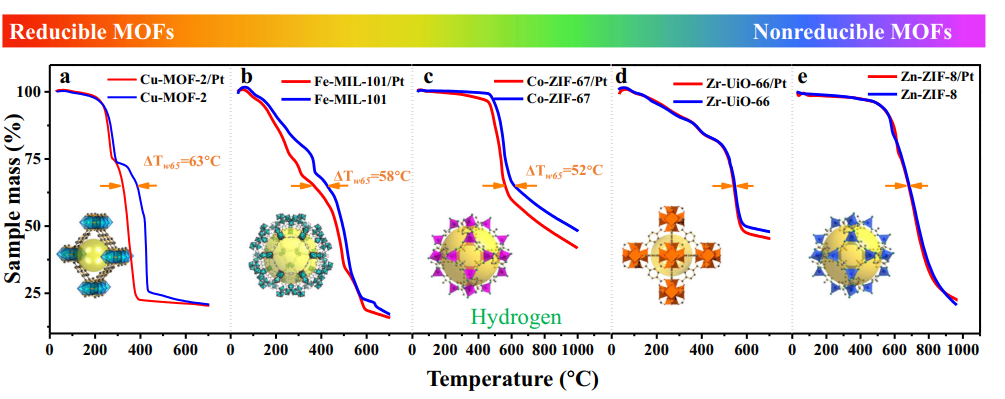
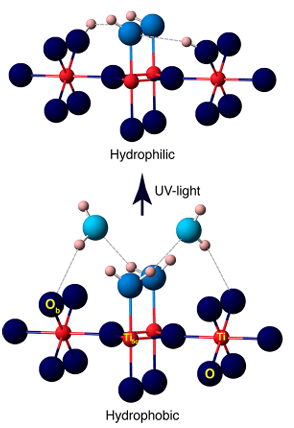
4. Formation d'hydroxyle induite par photocatalytique/UV
La lumière UV excite les semi-conducteurs tels que TiO2 pour générer des paires d'électrons-trous, qui capturent les atomes d'oxygène de surface pour former O⁻, puis réagissent avec des molécules d'eau adsorbées ou des groupes hydroxyles pour générer des OH⁻ de surface, accompagnés de la production de radicaux hydroxyles (· OH). Des expériences ont montré que l'irradiation UV génère des lacunes d'oxygène supplémentaires à la surface du TiO2, qui réagissent en outre avec l'eau pour générer davantage de groupes hydroxyle, conduisant à une superhydrophilie photo-induite.
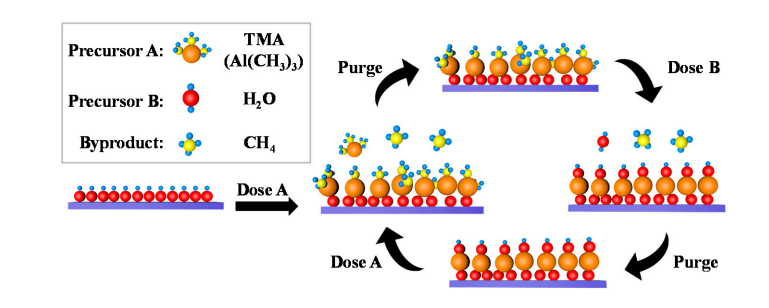
5.Formation de groupes hydroxyles à la surface de l'oxyde d'aluminium
Une petite quantité de groupes hydroxyles existent naturellement à la surface de l'oxyde d'aluminium, et les molécules d'eau se dissocient et s'adsorbent sur ces groupes hydroxyles, produisant du nouvel Al-OH. Lors du dépôt de couche atomique (ALD), le TMA (triméthylaluminium) subit un échange de coordination avec les groupes hydroxyle de surface pour former des liaisons Al-O-Al et libérer du méthane ; Par la suite, l'impulsion d'eau réagit à nouveau avec les liaisons Al-O pour régénérer les groupes hydroxyles de surface, obtenant ainsi une régénération cyclique des groupes hydroxyles.
6.Reconstruction de surface - La migration des métaux conduit à l'agrégation d'hydroxyles
Sur la surface cristalline de l'alumine ou de l'oxyde de titane, les ions métalliques locaux (tels que Al3+) migrent vers les lacunes de surface à haute température ou à fort potentiel hydrochimique, formant des amas hydroxyles de type Al (OH) 3 ou Ti (OH) 3. Cette reconstruction s'accompagne d'une distorsion du réseau, qui rend plus favorable l'adsorption des groupes hydroxyles sur les molécules d'eau adjacentes, formant ainsi une couche de base hydroxyle à haute densité.
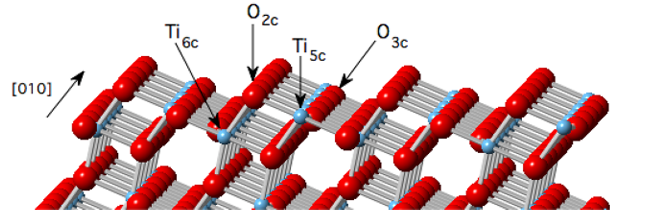
7. Le mécanisme d'hydrolyse des groupes hydroxyles à la surface du silicium
Au niveau de la liaison pont Si-O-Si, les molécules d'eau se combinent avec la liaison silicium-oxygène par transfert synergique d'électrons protons, formant des groupes Si-OH. Ce processus est particulièrement important dans la corrosion sous contrainte au fond de fissure et dans l'hydrolyse superficielle du verre, et l'amélioration des vibrations de traction Si-OH a été directement observée par spectroscopie infrarouge expérimentale.
SAT NANO est l'un des meilleurs fournisseurs de nanopoudres et de microparticules en Chine. Nous pouvons proposer de la poudre de nanotubes de carbone, telle que
MWCNT-COOH,
MWCNT-OH, si vous avez des questions, n'hésitez pas à nous contacter à sales03@satnano.com